HUKUM DALTON DAN HUKUM GAY LUSSAC

di susun oleh :
NAMA : AFRIANTI B
NIM : 0100140477
PROGRAM STUDI PENDIDIKAN KIMIA
JURUSAN PENDIDIKAN MATEMATIKA DAN IPA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS CENDERAWASIH JAYAPURA
2017
HUKUM DALTON DAN HUKUM GAY LUSSAC
A. HUKUM DALTON
Dari dua unsur dapat dibentuk beberapa senyawa dengan perbandingan massa yang berbeda-beda. Misalnya, unsur belerang dengan unsur oksigen dapat membentuk senyawa SO2 dan SO3. Dari unsur hidrogen dan oksigen dapat dibentuk senyawa H2O dan H2O2.Dalton menyelidiki perbandingan unsur-unsur tersebut pada setiap senyawa dan didapatkan suatu pola keteraturan. Pola tersebut dinyatakan sebagai Hukum Perbandingan Berganda.“bila dua unsur dapat membentuk lebih dari satu senyawa, dan jika massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana”.Contoh :Unsur Nitrogen dan unsur Oksigen dapat membentuk senyawa-senyawa N2O, NO, N2O3, dan N2O4 dengan komposisi massa terlihat dalam tabel berikut.
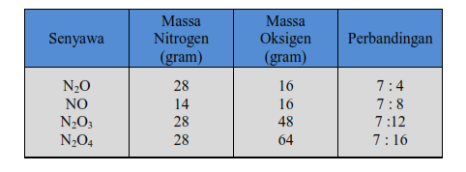
Dari tabel tersebut bila massa Nitrogen dibuat tetap (sama) sebanyak 7 gram, maka perbandingan massa oksigen dalam N2O : NO : N2O3 : N2O4 = 4 : 8 : 12 : 16 atau 1: 2:3:4.
B. HUKUM PERBANDINGAN VOLUM (HUKUM GAY LUSSAC)
Henry Cavendish (1731 – 1810), seorang ahli kimia berkebangsaan inggris, menemukan fakta bahwa perbandingan volum hidrogen : volum oksigen dapat membentuk aor adalah 2 : 1, dengan syarat kedua gas itu di ukur pada suhu (T) dan tekanan (P) yang sama. Pada tahun 1809, Joseph Louis Gay Lussac (1778 – 1850) asal Prancis tertarik pada penemuan tersebut, kemudian melakukan percobaan terhadap berbagai reaksi gas dan menemukan hasil sebagai berikut.
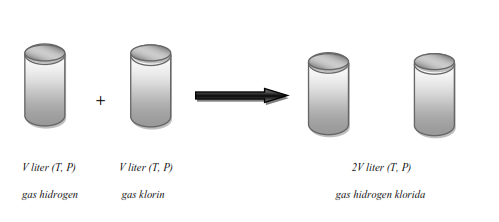
1). Pada reaksi antara gas hydrogen dengan gas klorin membentuk gas hydrogen klorida, perbandingan volumnya adalah 1 : 1 : 2.
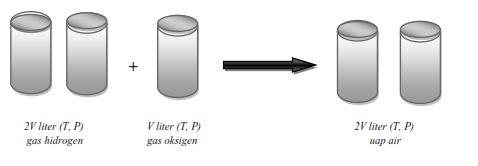
2). Pada reaksi antara gas hidrogen dengan gas oksigen membentuk uap air, perbandingan volumnya adalah 2 : 1 : 2.
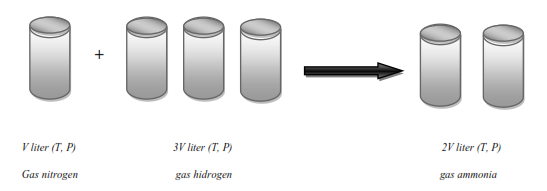
3). Pada reaksi antara gas nitrogen dengan gas hidrogen membentuk ammonia, perbandingan volumnya adalah 1 : 3 : 2.
Gay Lussac menyimpulkan penemuannya dalam suatu hukum yang disebut hukum perbandingan volum, sebagai berikut : “bila diukur pada suhu dan tekanan yang sama volum gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana”.
Ilmuwan Perancis Joseph Louis Gay Lussac (1778-1850) berhasil melakukan percobaan tentang volum gas yang terlibat pada berbagai reaksi. Setiap satu satuan volum gas hidrogen bereaksi dengan satu satuan volum gas klorin akan menghasilkan dua satuan volum gas hidrogen klorida. Setiap dua satuan volum gas hidrogen bereaksi dengan satu volum gas oksigen akan menghasilkan dua satuan volum uap air.
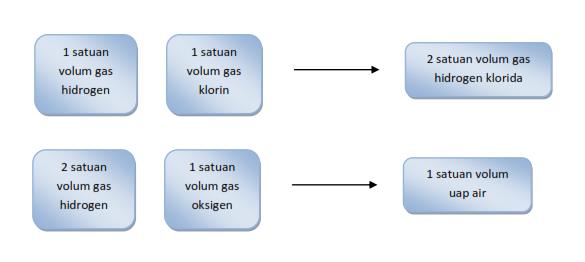
Dari percobaan-percobaan yang telah dilakukannya, Gay Lussac berkesimpulan bahwa :
Volum gas-gas yang bereaksi dan volum gas-gas hasil reaksi bila diukur pada suhu dan tekanan yang sama berbanding sebagai bilangan bulat dan sederhana. (Hukum Perbandingan Volum).
Hasil percobaan diatas menunjukkan bahwa :
Volum gas hidrogen : klorin : hidrogen klorida = 1 : 1 : 2,
Volum gas hidrogen : oksigen : uap air = 2 : 1 : 2.1
Volum hidrogen + 1 volum klorin → 2 volum hydrogen klorida.
Hukum perbandingan volum tersebut hanya berlaku untuk reaksi-reaksi dalam wujud gas, dan pada kenyataannya untuk reaksi yang bukan gas, massa zat dan volum zat cair tidak berlaku. Bila dihubungkan dengan teori atom Dalton, terdapat ketidaksesuaian, karena Dalton menganggap bahwa atom merupakan partikel terkecil dari suatu zat. Bila dianggap bahwa gas-gas dalam keadaan sebagai atom, sehingga didapat :
1 atom hydrogen + 1 atom klorin → 2 atom hydrogen klorida
Bila konsep ini diterapkan pada gas hIdrogen dan oksigen, maka di peroleh :
1 atom hydrogen + 1/2 atom oksigen → 1 atom air
Konsep setengah atom bertentangan dengan teori atom Dalton, sebab tidak ada atom yang hanya separuh. Untuk menghindari hal tersebut Amadeo Avogadro mengusulkan hipotesis yang disebut sebagai Hipotesis Avogadro.
